文/淡水馬偕紀念醫院醫學研究部研究助理柯俊銓
訪談主題期刊:BAFF-driven NLRP3 inflammasome activation in B cells. Cell Death Dis. 2020;11(9):820.
臨床醫師有著直接面對病人在疾病威脅的急迫壓力,但也只有他們能清楚瞭解疾病對患者的直接影響,所以其醫學研究常以臨床實用性為主。當臨床醫療上缺乏有效的醫療方法與相關技術時,即對現有醫療方法與相關技術「改良」與「新開發」,或是反向做法對疾病進行「解析」,對疾病致病機轉的分解剖析與逐項釐清;相較於「改良」與「新開發」更遠離臨床實用範疇,但是對這兩者而言,卻是奠定其成長發展的重要起點與基石,本篇林建鴻醫師的論文研究就是這樣典型範例。
發炎體(inflammasome)是細胞內由多種蛋白質組成的大型聚合蛋白體,在先天免疫扮演關鍵角色,為細胞凋亡酶(Cysteine Aspartic Protease, Caspase)活化所必需的反應平臺。細胞內受到感染或刺激能活化發炎體,並誘導發炎性細胞激素interleukin (IL)-1β與IL-18的成熟分泌,進而產生先天免疫反應。先天免疫反應的活化包含許多細胞的參與,這些細胞上表現的接受器即所謂的模式識別受體(Pattern-recognition receptors, PRRs)。
基於分佈位置不同,PRRs可分為細胞膜上的Toll樣受體(Toll-like receptors, TLRs)、C型凝集素受體(C-type lectin receptors, CLRs)與細胞內部的NOD樣受體(NOD-like receptors, NLRs)和RIG-I樣受體(RIG-I-like receptors, RLRs)。前者能誘發不同的訊息傳遞而活化NF-κB、AP-1及干擾素調控因子(Interferon-regulatory factor)等轉譯因子,產生發炎的細胞激素及介質,後者主要監控細胞內的病原體及危險信號,同樣可活化轉譯因子及產生發炎反應。
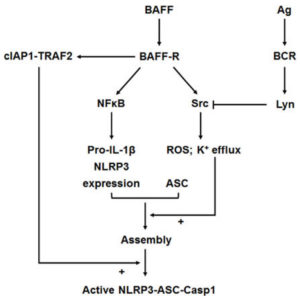
本篇論文研究主題NLRP3發炎體是由NLRs亞家族的NLRP3(NOD-, LRR- and pyrin domain-containing protein 3)、細胞凋亡相關似微粒蛋白含細胞凋亡蛋白酶募集區域(Apoptosis-associated speck-like protein containing a caspase recruitment domain [CARD], ASC)與前細胞凋亡酶-1(Pro-caspase-1)所組成。當Toll樣受體識別到刺激訊號時就會釋放NF-κB(Nuclear factor kappa-light-chain-enhancer of activated B cells)進入細胞核內,啟動轉錄程序合成NLRP3、Pro-IL-1β與Pro-IL-18至細胞質內,NLRP3組成NLRP3發炎體後活化Pro-caspase-1成為Caspase-1,進而活化Pro-IL-1β與Pro-IL-18成為具活性的IL-1β與IL-18,結果產生發炎反應或細胞凋亡過程。
在B細胞(B cells)上的NLRP3發炎體主要分兩種啟動路徑:B細胞受體(B-cell receptor, BCR)與B細胞啟動因子(B cell-activating factor, BAFF)搭配B細胞啟動因子受體(BAFF receptor 3, BR3, BAFFR),前者屬於典型NF-κB1路徑(Canonical NF-κB1 pathway),由多種促發炎細胞因子(如TNFα或IL-1)、細菌模式識別分子(如LPS)或抗原刺激所觸發,導致IκB激酶(IκB kinase, IKK)活化,後者屬於非典型NF-κB2路徑(Non-canonical NF-κB2 pathway),由TNF家族其他受體(如LTβR、BAFFR、CD40)及其配體所觸發,導致NIK激酶(NF-κB-inducing kinase)活化。兩種路徑的信號傳導機制存在差異且具有相互消長的箝制關係,如刺激BAFFR會提高TNF受體相關因子3(TNF receptor-associated factor 3, TRAF3)使NIK激酶釋放,活化NF-κB2路徑的同時會抑制NF-κB1路徑。
研究結果發現BAFF可以通過促進cIAP(cellular inhibitor of apoptosis protein細胞凋亡蛋白的細胞抑製劑)-TRAF2與NLRP3發炎體成分的結合、誘導Src活性依賴性的ROS產生,與鉀離子流出去,進而活化NLRP3發炎體(如圖)。BCR對Lyn信號通路的刺激抑制BAFF誘導的Src活性並減弱BAFF誘發的NLRP3發炎體活化,因此Lyn在啟動BCR信號傳導方面發揮著重要作用。BCR和BAFFR間通過活化兩種NF-κB路徑的串擾表明兩者對B細胞存活的調節是相互關聯的。BAFF通過發炎體的活化引發B細胞發炎,BCR活動則能抑制BAFF驅動的發炎體活化和細胞死亡,在兩者之間是否還有更多的關連,是未來延伸研究的主題。
林建鴻醫師的研究團隊自2014年陸續探討B細胞活化相關主題,團隊成員中也爭取到科技部計畫繼續探討這方面的題目。關於抑制NLRP3發炎體所造成的發炎反應,多數研究都是開發其抑制劑,但其研究團隊選擇延續過去BAFF研究,觀察到高劑量BAFF會造成B細胞死亡,進而探討研究其作用機轉,最後發現是透過NLRP3發炎體能造成B細胞死亡。
研究發現BAFF誘發NLRP3發炎體有很多路徑可利用,目前研究的疾病是B細胞淋巴癌,初步顯示BAFF可用來控制B細胞淋巴癌生長。除了持續探討BAFF在B細胞淋巴癌治療上的角色,希望將來也可應用在其他B細胞白血病的治療上。引發NLRP3發炎體的途徑不僅只有BAFF,是否可利用BAFF作為干涉影響其他源頭以降低過敏發炎,為未來研究方向之一。
BAFF-BAFFR抑制BCR的效果,用在B細胞淋巴癌的研究和免疫發炎反應上不同,目前看來免疫發炎反應要考慮使用BAFF拮抗劑治療,和B細胞淋巴癌治療方向恰好相反。而NLRP3發炎體在許多疾病致病過程中扮演重要角色,除了會因為細菌及病毒感染活化,還會被體內代謝相關危險分子活化,例如高血脂、高膽固醇、高尿酸、高血糖等,也會因為吸入空氣汙染的PM2.5活化。過度活化的NLRP3發炎體會導致許多疾病發生與惡化,包括癌症、第二型糖尿病、心血管疾病、腎臟病、神經退化性疾病、痛風、關節炎、發炎性腸道疾病、帕金森氏症等。
現代人因環境污染及生活型態的改變增加許多罹患文明病的風險,NLRP3發炎體活化的預防及治療是目前醫學研究上的重點目標。「惟獨從上頭來的智慧,先是純潔的,後是和平的、和藹的、柔順的,滿有憐憫和善果,沒有偏見,沒有假冒。」《雅各書 3:17》,林建鴻醫師的研究團隊希望在科學研究的過程中有天上賦予的智慧,同時抱持一個純潔、真實的心,為科研問題找尋答案,並期望研究的成果未來能為廣大患者找尋到健康生活的生命之路。◎
